竺立哲教授團隊在著名期刊 J. Chem. Theory Comput. 發表封面文章
近日,香港中文大學(深圳)生命與健康科學學院、瓦謝爾計算生物研究院竺立哲教授研究組在知名國際期刊Journal of Chemical Theory and Computation發表封面文章 “Assessing the performance of Traveling-salesman based Automated Path Searching (TAPS) on complex biomolecular systems”,展示了自研的自動化路徑搜索算法TAPS的易用性及整體效率。基于此,該方法有望成為研究復雜生物大分子功能性構象變化機制的通用方法,并在藥物研發、蛋白質工程等領域發揮重要作用。
香港中文大學(深圳)生命與健康科學學院為第一單位,生命與健康科學學院瓦謝爾計算生物研究院席昆博士為論文的第一作者,竺立哲教授為通訊作者,另有胡禎全博士和三位香港中文大學(深圳)本科生參與此項工作。
?

點擊圖片,閱讀全文
?
01?研究簡介
生物大分子的功能實現往往伴隨著重要的結構轉變,但現有的實驗方法很難獲取此轉變過程的完整細節,需借助分子動力學模擬予以呈現。然而,受生物大分子本身的復雜性及計算資源所限,普通分子動力學模擬的長度只能達到微秒級別,遠低于生物大分子功能性構象變化所需毫秒級以上的時間尺度,無法直接被用于觀測該過程。為此,人們研發了各種算法,期以較小的代價,獲得可準確描述這些構象變化的最大概率(最小自由能)路徑。但這些算法大都非常依賴于事先對變化過程機制的猜測,自動化程度和整體效率較低(見圖1)。

?
這些方法通常先通過各種增強采樣算法得到一條猜測的初始路徑,而后基于對機理的猜測來選定具有物理意義的坐標變量(Collective Variable,CV),在此變量空間內進行路徑搜索,找到初始猜測路徑附近的最小自由能路徑(圖1B)。上述傳統路徑搜索方法的整體效率主要受限于兩個因素:(a) 其路徑上節點周圍的采樣通常是局部的,導致路徑向最小自由能路徑的演化非常緩慢;(b) 路徑本身定義在先驗選擇的低維坐標變量 (CV) 空間,嚴重依賴于對系統的先驗性知識,而這對于高維度的復雜生物大分子系統異常困難。
?
?
TAPS方法則直擊這些痛點。首先,TAPS采用非局部采樣,可進行垂直于猜測路徑的快速搜索,并用旅行商求解器解決因此帶來的路徑節點順序重排問題,提高了搜索效率(圖1A)。另外,TAPS實現了高度自動化,即無需進行預選擇的靜態集體變量空間定義,而是通過定義描述高維構象間的距離(RMSD),來計算得到路徑變量 (Path Collective Variable,PCV),進而在此高維空間搜索得到最小自由能路徑,而后再依據所得高維路徑準確提取與結構變化機制關聯緊密的坐標信息(圖1B),從而最大限度地將對機制的猜測和解釋從搜索采樣過程中剝離出來。
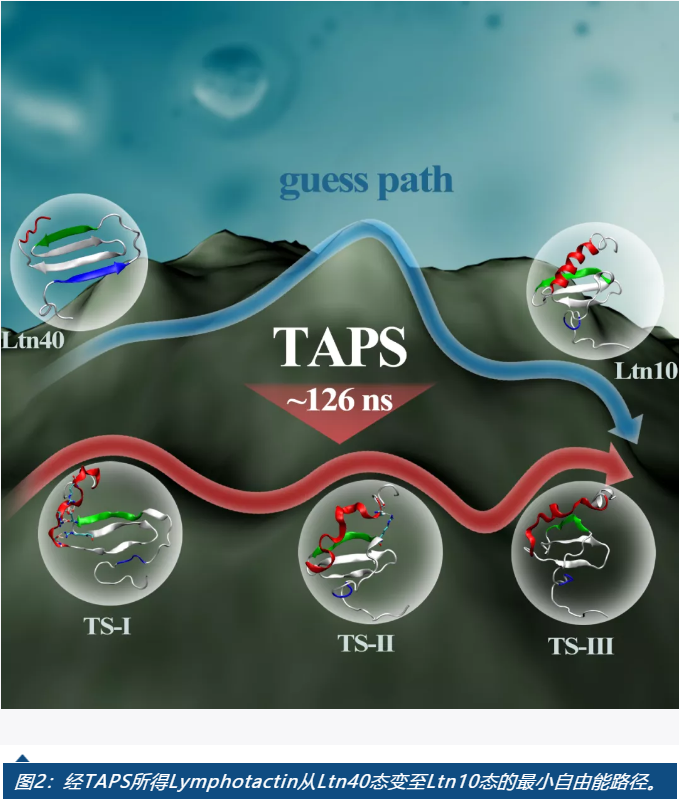
本研究基于Python3,實現了TAPS采樣過程的并行化和GPU加速(https://github.com/xikun2020/TAPS),新增了可快速評估路徑搜索是否收斂的計算模塊,增加了方法的通用性與易用性。基于此平臺,本研究全面揭示了三種蛋白質的重要功能性構象變化機制,即T4 Lysozyme L99A由基態(State G)轉變為激活態(State E)、激酶分子MEK1從Loop-Out狀態到達Loop-In狀態以及對溫度敏感的淋巴趨化因子Lymphotactin(Ltn)由Ltn40到Ltn10的轉變機制。其中,尤以Ltn體系涉及大量二級結構變化最為復雜,但TAPS只需126ns的采樣總量便獲得了Ltn40至Ltn10的最小自由能路徑,揭示了此轉變中結構去折疊與再折疊的具體機制,獲取了關鍵中間態和過渡態結構(見圖2)。
鑒于其高效自動化的特征,TAPS算法為建立一套研究復雜生物大分子構象變化的通用算法平臺提供了堅實基礎。完善該平臺則有賴于對TAPS的進一步優化。首先,由于 TAPS中的路徑定義在高維空間、所含節點是完整的分子體系,我們還可根據所得路徑節點的特征,更新定義RMSD所需的原子集,在路徑搜索過程中自動完成計算RMSD的原子集的優化,進一步提升自動化程度。此外,由于生物大分子的構象變化過程常存在多條并行路徑,如何以低成本一次性獲得多條最小自由能路徑也將是TAPS平臺下一步發展的重要課題。
?
02?項目主持人

竺立哲博士,現為香港中文大學(深圳)生命與健康科學學院與瓦謝爾計算生物研究院助理教授。竺教授畢業于阿姆斯特丹大學化學系,彼時作為瑪麗居里青年研究員,通過分子模擬手段研究蛋白質受體異位效應的機理,后于2012年赴香港科技大學從事博士后研究,致力于增強抽樣算法同馬爾可夫態模型方法的整合,至今已在國際主流期刊發表論文近30篇,總引用近400次(Google Scholar)。竺教授目前的研究興趣包括機器學習與增強采樣算法的融合、核酸與蛋白質相互作用、基因編輯工具的動力學機制、膜蛋白藥物研發等。
?
文章轉自香港中文大學(深圳)生命健康學院微信公眾號,鏈接為https://mp.weixin.qq.com/s/9LZTdpQ9bJx5dj8tCs6Apw





