生命與健康科學學院杜洋教授聯合國內多個大學在《Cell》發表封面文章
近日,香港中文大學(深圳)生命與健康科學學院、科比爾卡創新藥物開發研究院杜洋教授,聯合四川大學、山東大學、北京大學、西安交通大學團隊,合作在《Cell》雜志發表了他們最新研究成果的封面文章 ——“Ligand recognition and allosteric regulation of DRD1-Gs signaling complexes”。
香港中文大學(深圳)生命與健康科學學院杜洋教授、四川大學華西醫院邵振華教授、山東大學于曉教授、西安交通大學張磊教授和北京大學孫金鵬教授為共同通訊作者。香港中文大學(深圳)生命與健康科學學院竺立哲教授、香港中文大學在讀博士生、科比爾卡創新藥物開發研究院研究助理曹昇為論文共同作者。
?

?
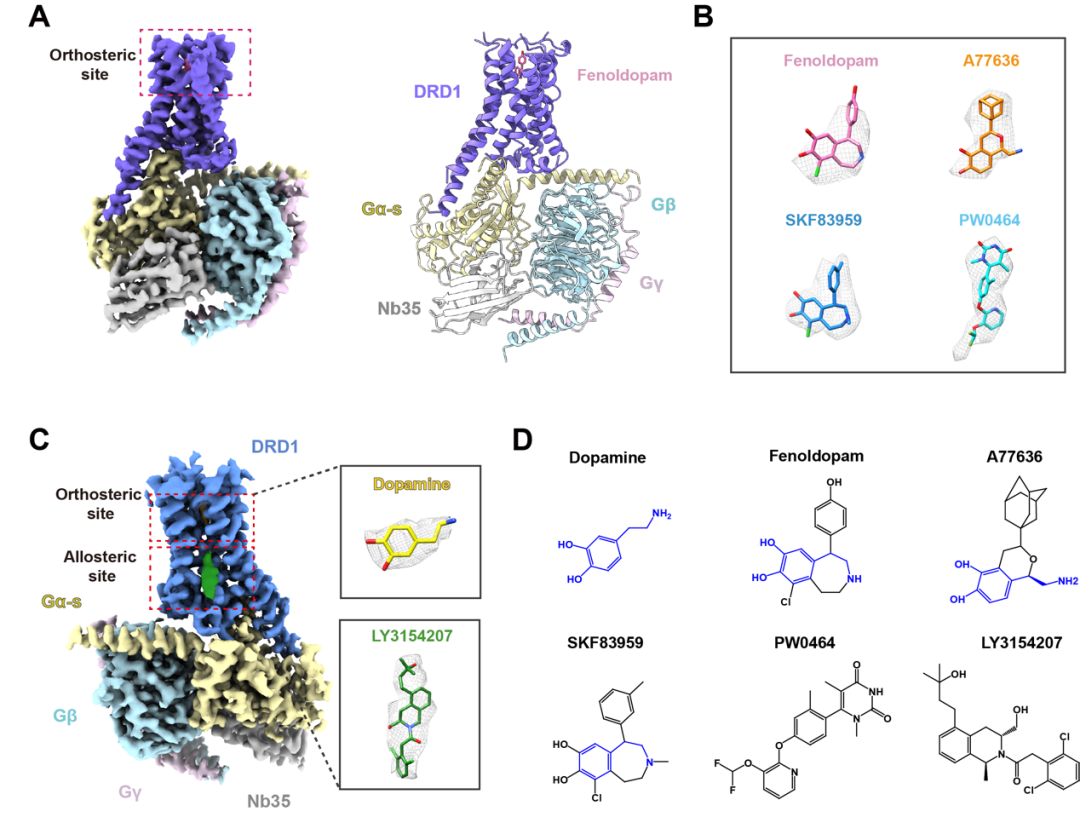
該研究采用冷凍電鏡技術首次解析了DRD1-Gs復合體分別結合兒茶酚類(Catechol like)激動劑(降血壓藥Fenoldopam、完全激動劑A77636和G蛋白偏向性激動劑SKF83959)、非兒茶酚類(Non-catechol like)激動劑PW0464及同時結合“快樂荷爾蒙”Dopamine和正向別構調節劑LY3154207的三維結構。
?

?
多巴胺(Dopamine)是一種能夠給人帶來愉悅感受的神經遞質,在中樞神經系統疾病治療中具有極為重要作用,被稱為人體“快樂激素”。多巴胺通過多巴胺受體調節多種生理過程,如獎賞、成癮、記憶、新陳代謝和激素分泌【1-3】。1976年,多巴胺受體被鑒定為響應內源性多巴胺的GPCR亞家族,研究表明多巴胺受體家族是治療神經退行性等疾病的直接靶標。多巴胺受體有5個成員,分為兩類:D1類受體和D2類受體兩個亞家族,其中D1類受體(DRD1和DRD5)通過激活Gs/Golf和刺激環磷酸腺苷(CAMP)的產生,調節中樞神經系統獎賞、運動和認知,并在外周組織中發揮有益的作用,包括抑制炎癥反應和維持心血管和腎臟的動態平衡【1,4】。相比之下,D2類受體(DRD2、DRD3和DRD4)與Gi/Go偶聯,抑制cAMP積累并調節不同的生理效應【3,5】。五種多巴胺受體亞型具有很高的序列同源性、識別相同的內源性配體,針對這五種亞型的藥物開發已取得重要進展,但是,多巴胺受體亞型之間對激動劑識別、配體選擇性、受體激活和G蛋白選擇性的機制仍不清楚。目前為止,D2類受體識別拮抗劑配體的分子機制【6-8】,選擇性激動劑Bromocriptine激活DRD2-Gi信號轉導復合物的分子機制相繼被揭示【9】。然而,D1類亞家族識別配體的結構基礎仍然缺乏,高選擇性激動劑藥物是治療帕金森病以及腎損傷高血壓的臨床需求【10-12】。D1類多巴胺受體的結構基礎將為選擇性激動劑開發提供理論依據。
?
?
本研究對多巴胺受體的配體識別、激活機理以及信號轉導選擇等都具有廣泛的影響,列舉如下:1. 揭示了DRD1的正位結合口袋(orthosteric binding pocket,OBP)識別內源性荷爾蒙多巴胺及兒茶酚類激動劑配體的機制;2. 闡明了DRD1的非兒茶酚類激動劑結合模式;3. 揭示了DRD1延伸結合口袋(extended binding pocket ,EBP)的特征;4. 提出了DRD1對G蛋白偶聯和選擇性的關鍵殘基;5. 發現了DRD1的正向別構調節(positive allosteric modulator,PAM)位點。特別值得一提的是,LY3154207是由禮來公司于2019年首次報道,目前仍處于臨床二期研究,用于治療癡呆癥(Lewy body dementia)。在藥理學上,該藥物表現出顯著的正向別構效應,能顯著增強DRD1對內源性激動劑多巴胺的結合能力和信號轉導效應。結構顯示LY3154207結合在第二個胞內環(ICL2)、TM3和TM4形成的膜包埋結合位點,PAM結合口袋主要由疏水殘基組成,通過信號轉導藥理學實驗和分子動力學模擬對該位點進行了驗證,為別構小分子藥物的設計提供了理論基礎。
?
綜上所述,該團隊利用單顆粒冷凍電鏡技術解析了多巴胺受體DRD1與G蛋白的復合物結構,從而在原子層面上詳細闡釋了DRD1的配體識別、別構調節及與G蛋白偶聯的機制,該項研究將為高血壓、帕金森綜合癥、腎損傷等疾病的藥物開發和治療帶來新的曙光。
?
原文鏈接:
https://doi.org/10.1016/j.cell.2021.01.028
?
參考文獻:
1.Beaulieu, J.M., Gainetdinov, R.R., 2011. The physiology, signaling, and pharmacology of dopamine receptors. Pharmacol. Rev. 63, 182–217
2. Kebabian, J.W., Calne, D.B., 1979. Multiple receptors for dopamine. Nature 277, 93–96.
3. Missale, C., Nash, S.R., Robinson, S.W., Jaber, M., Caron, M.G., 1998. Dopamine receptors: from structure to function. Physiol. Rev. 78, 189–225.
4. Yan, Y., Jiang, W., Liu, L., Wang, X., Ding, C., Tian, Z., Zhou, R., 2015. Dopamine controls systemic inflammation through inhibition of NLRP3 inflammasome. Cell 160,62–73.
5. Spano, P.F., Govoni, S., Trabucchi, M., 1978. Studies on the pharmacological properties of dopamine receptors in various areas of the central nervous system. Adv. Biochem. Psychopharmacol. 19, 155–165.
6. Chien, E.Y., Liu, W., Zhao, Q., Katritch, V., Han, G.W., Hanson, M.A., Shi, L., Newman, A.H., Javitch, J.A., Cherezov, V., Stevens, R.C., 2010. Structure of the human dopamine D3 receptor in complex with a D2/D3 selective antagonist. Science 330, 1091–1095.
7. Wang, S., Wacker, D., Levit, A., Che, T.,?Betz, R.M., McCorvy, J.D., Venkatakrishnan, A.J., Huang, X.P., Dror, R.O., Shoichet, B.K., Roth, B.L., 2017. D4 dopamine receptor high-resolution structures enable the discovery of selective agonists. Science 358, 381–386.
8. Wang, S., Che, T., Levit, A., Shoichet, B.K., Wacker, D., Roth, B.L., 2018a. Structure of the D2 dopamine receptor bound to the atypical antipsychotic drug risperidone. Nature 555, 269–273.
9. Yin, J., Chen, K.M., Clark, M.J., Hijazi, M., Kumari, P., Bai, X.C., Sunahara, R.K., Barth, P., Rosenbaum, D.M., 2020. Structure of a D2 dopamine receptor-G-protein complex in a lipid membrane. Nature 584, 125–129.
10. Gurrell, R., Duvvuri, S., Sun, P., DeMartinis, N., 2018. A Phase I Study of the Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of the Novel Dopamine D1 Receptor Partial Agonist, PF-06669571, in Subjects with Idiopathic Parkinson’s Disease. Clin. Drug Investig. 38, 509–517.
11. Nichols, A.J., Ruffolo, R.R., Jr., Brooks, D.P., 1990. The pharmacology of fenoldopam. Am. J. Hypertens. 3, 116S–119S.
12. Noce, A., Marrone, G., Rovella, V., Busca, A., Gola, C., Ferrannini, M., Di Daniele, N., 2019. Fenoldopam Mesylate: A Narrative Review of Its Use in Acute Kidney Injury. Curr. Pharm. Biotechnol. 20, 366–375.
?
個人簡介

?
杜洋教授現任香港中文大學(深圳)生命與健康科學學院助理教授、博士生導師,科比爾卡創新藥物開發研究院責任研究員。2011年于中國科學技術大學取得博士學位,之后赴美國斯坦福大學醫學院分子與細胞生理學系,師從2012年諾貝爾化學獎得主布萊恩·科比爾卡(Brian Kobilka)教授,從事G蛋白偶聯受體(GPCR)相關的博士后訓練和研究科學家聘用工作。期間獲授美國心臟協會(American Heart Association)全額博士后獎學金和斯坦福心血管研究所資助等。杜教授的主要研究方向是以β2腎上腺素受體(beta-2 adrenergic receptor)等重要藥物靶點的G蛋白偶聯受體(GPCR)為對象,研究其與下游信號分子復合物的結構、功能和分子藥理特性。





